Por José Manuel Echevarría. Profesor Honorífico, Facultad de Biología, UCM. Miembro de la Orden Civil de Sanidad
Portada

La ciencia y la tecnología están muy presentes en la sociedad actual. Muchas de las historias que se nos cuentan hoy contienen elementos de carácter técnico o científico. En esos casos, la palabra experto se convierte en palabra clave para la credibilidad de la historia, mucho mejor si puede utilizarse en plural. Sin embargo, rara vez pasa que los expertos en algún campo concreto de la ciencia se pongan unánimemente de acuerdo sobre algo que aún pueda ser razonablemente discutido. Además, es prácticamente imposible recopilar y acordar las opiniones de todos los expertos acerca de una cuestión así. Cuando se habla de expertos nunca se trata, por consiguiente, de todos ellos, sino como mucho de una mayoría cuyo numerador y denominador jamás se especifica y muy rara vez se conoce.
Estas son las palabras que escribí en el antepenúltimo párrafo del prólogo de ¿Alerta pandémica?, un relato de ficción basado en los hechos de la pandemia de gripe de 2009 que publiqué en 2011. Como resultan de plena aplicación a la situación que vivimos hoy, las cito aquí para justificar el subtítulo de esta charla. Todo lo que sigue a continuación trata de establecer hechos sobre la pandemia del SARS-CoV-2 y de reflexionar honestamente sobre ellos, pero solo es, en definitiva, el punto de vista personal de un viejo experto en estos temas. Nada más.
Introducción y antecedentes del tema
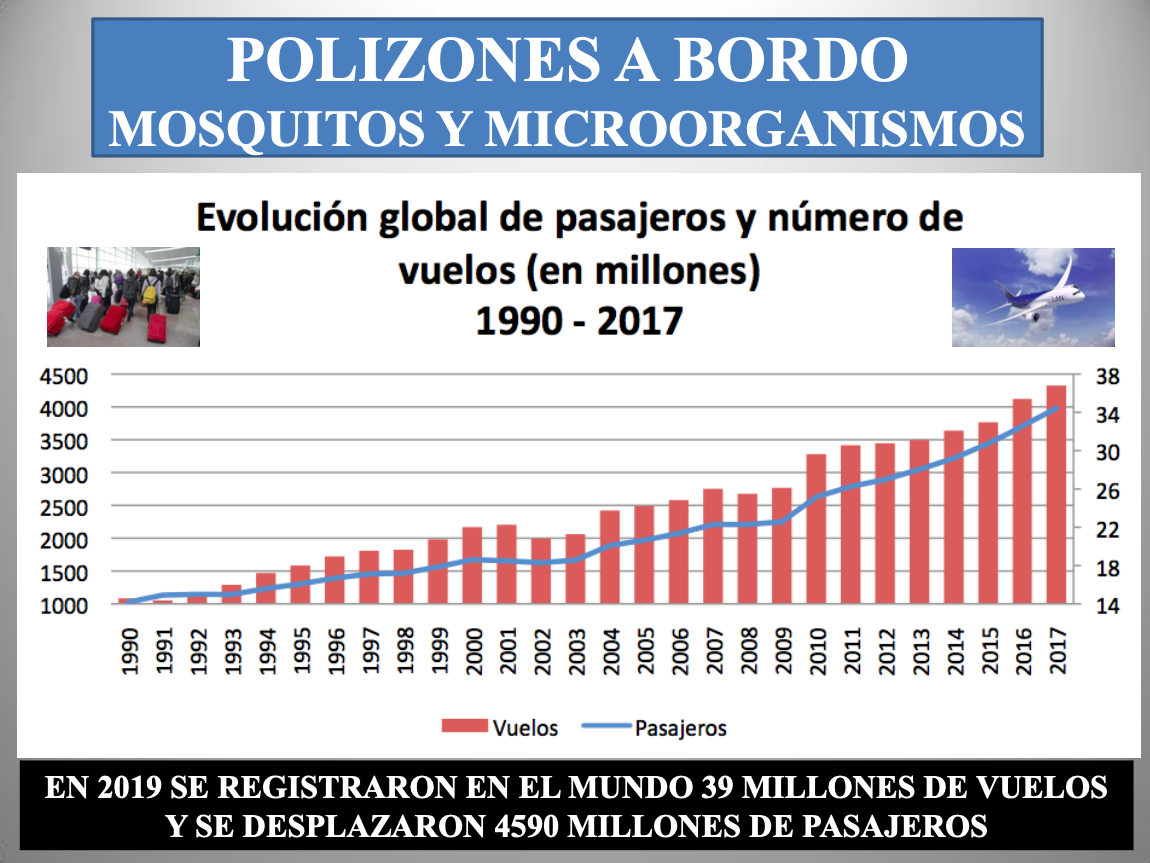
Diap 1. Se barajan varios factores para explicar que en los últimos años se haya multiplicado la frecuencia de irrupción de nuevos agentes infecciosos entre la población humana. En el caso de que esta sensación respondiese a la realidad, y no al vertiginoso desarrollo de nuestra capacidad de detectarlos e identificarlos gracias a las cada vez más potentes herramientas de la biología molecular, yo apostaría por este como el más influyente. Desde hace tiempo, los agentes infecciosos de distribución geográfica restringida han pasado a la historia, y se da la paradoja de que un ciudadano de Madrid pueda verse más expuesto a uno emergido en Shanghái que a otro surgido el mismo día en Argel.

Diap 2. Para introducir el tema, viene bien echar mano de la historia para buscar antecedentes, un ejercicio que nos trae ejemplos desde la Antigüedad hasta tiempos muy recientes. El artículo de la derecha ilustra la emergencia de enfermedades infecciosas en la antigua Roma, que bien pudo contar con la primera expansión por Europa de un virus muy semejante al virus Ébola (la Plaga de Cipriano) [1]. El de arriba da noticia de lo que suponía la importación de la fiebre amarilla desde América para la España de principios del siglo XIX [2]. Los brotes progresaban localmente entre la población humana hasta involucrar a su práctica totalidad, y fue así que el sucedido en la ciudad de Alicante en 1804 mató al 20% de sus residentes en el transcurso de dos meses. La ciudad fue puesta en cuarentena bajo cerco militar, y la medida no se levantó hasta que el brote se desactivó por sí mismo. Para más información sobre la inmensa incidencia de los mosquitos en la historia de la humanidad, recomiendo leer “El mosquito” (Timothy Winegard, 2009, traducción al español de 2019).

Diap 3. El concepto de agente infeccioso emergente es un tanto difuso porque incluye varias opciones distintas. En el sentido más estricto, un virus emergente es el que cumple con las condiciones del punto 1 del recuadro superior y las del punto 2 del recuadro inferior. El virus que nos ocupa hoy satisface ambas.
 Diap 4. Tirando de mi archivo mental de vivencias profesionales, recuerdo haber vivido doce emergencias virales en los últimos treinta años, lo que supone la respetable media de una por cada tres-cuatro años. Esta es la lista de virus emergentes que yo he contabilizado desde que se puso de manifiesto la emergencia del VIH en la década de 1980 (la emergencia en sí sucedió mucho antes) hasta el día de hoy, en el que las medidas que se han tomado ante la del último de ellos nos impide celebrar esta charla como lo hacemos siempre. Se resaltan en negrita los cuatro virus que, como el SARS- CoV-2, son emergentes en el sentido más estricto y producen infecciones del aparato respiratorio que pueden resultar en neumonía y, ocasionalmente, producir la muerte.
Diap 4. Tirando de mi archivo mental de vivencias profesionales, recuerdo haber vivido doce emergencias virales en los últimos treinta años, lo que supone la respetable media de una por cada tres-cuatro años. Esta es la lista de virus emergentes que yo he contabilizado desde que se puso de manifiesto la emergencia del VIH en la década de 1980 (la emergencia en sí sucedió mucho antes) hasta el día de hoy, en el que las medidas que se han tomado ante la del último de ellos nos impide celebrar esta charla como lo hacemos siempre. Se resaltan en negrita los cuatro virus que, como el SARS- CoV-2, son emergentes en el sentido más estricto y producen infecciones del aparato respiratorio que pueden resultar en neumonía y, ocasionalmente, producir la muerte.
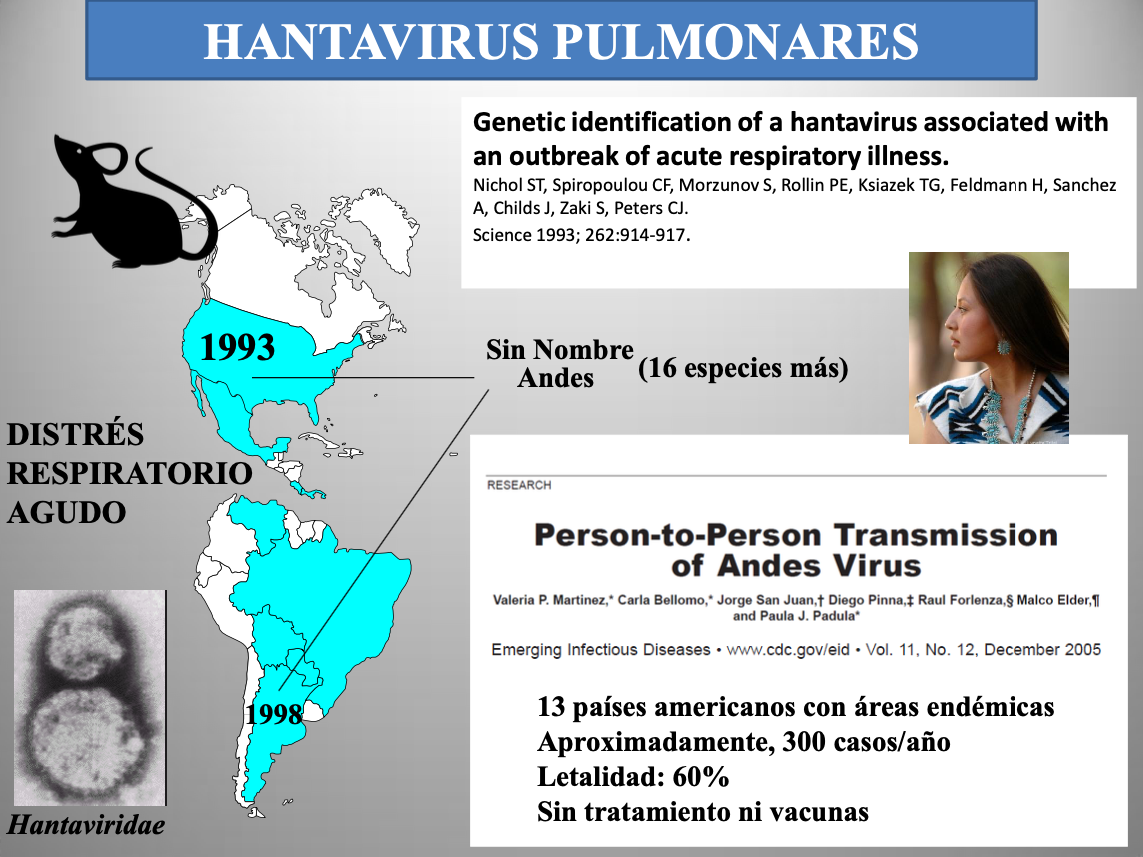
Diap 5. El virus “Sin Nombre” (SNV) fue el responsable del misterioso brote epidémico de distrés respiratorio agudo que mató en 1993 a varios amerindios norteamericanos, jóvenes y sanos, que residían en el paraje de Muerto Canyon (Arizona). Aquel incidente me impresionó tanto que me llevó a escribir mi primer relato de ficción (Amaroncachi, el agua de la anaconda). El SNV nos trajo la primera noticia de la existencia de los hantavirus pulmonares, unos agentes propios de roedores cricétidos del Nuevo Continente. Desde entonces, se le han unido ya otras 17 especies encontradas a todo lo largo de las Américas. Se trata de agentes zoonóticos que alcanzan accidentalmente a las personas y que no se transmiten entre ellas, pero un linaje concreto del virus Andes (ANDV, linaje Sout), la especie característica de Argentina, ha mostrado ya en cinco ocasiones que es capaz de originar brotes discretos por transmisión de persona a persona, el primero de ellos sucedido en 1998 [3]. Así pues, parece que este hantavirus pulmonar lleva al menos dos décadas ensayando su adaptación a la especie humana, y de conseguirlo podría quizá protagonizar un futuro evento epidémico de cierta entidad. Estos virus cuentan con parientes cercanos en Eurasia, pero esos producen enfermedades renales (nefrosonefritis epidémica, países nórdicos europeos) o fiebres hemorrágicas (virus Dobrava, Balcanes y Mediterráneo Oriental; virus Puumala, países nórdicos europeos; virus Seúl, norte de China y Corea).
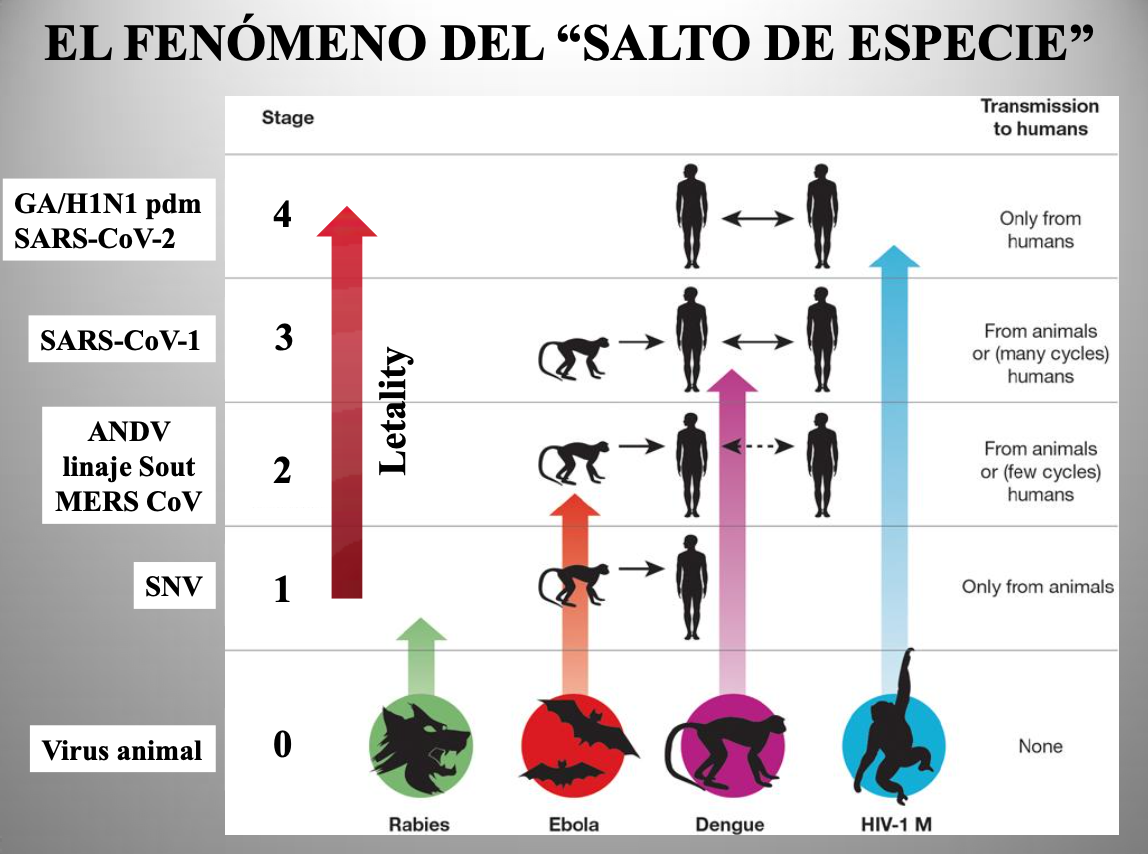
Diap 6. Con el ejemplo de los hantavirus pulmonares podremos comprender mejor el proceso que lleva a un virus propio de algún animal a coronar con el éxito su conversión en un nuevo virus humano (salto de especie). El estadío 1 vendría representado por el SNV, que solo es capaz de transmitirse del roedor reservorio a las personas. El estadío 2 supone un primer paso en la adaptación (el caso del linaje Sout del ANDV) en el que la transmisión inicial se sigue ocasionalmente de unas pocas transmisiones entre personas. Como veremos después, el MERS-CoV se debate también en esa tesitura. En el segundo paso (estadío 3), el virus causa brotes más amplios, pero su todavía imperfecta adaptación no le capacita para lograr más porque transmitirse de persona a persona aún le resulta difícil. El SARS-CoV-1 llegó hasta ahí, fracasó en su intento de llegar a más, y desapareció. Por último, superar con éxito ese segundo paso lleva al virus al estadío 4, permitiéndole iniciar una expansión pandémica que le certificará como nuevo virus humano. En ese episodio, su expansión será explosiva porque no tropezará con ninguna inmunidad previa en la población, cada ser humano que alcance será susceptible de infectarse y de transmitir la infección a otros. Así, con las mismas transmisibilidad y letalidad intrínsecas que otro virus ya establecido, producirá muchas más infecciones, y consecuentemente más muertes, en el mismo espacio de tiempo, causando la falsa sensación de que se trata de un agente intrínsecamente más transmisible y más letal. El SARS-CoV-2 se halla ahora en ello. Es característico que la adaptación completa lleve pareja la atenuación de la letalidad por selección natural, puesto que las variantes menos letales gozan de más oportunidades de transmisión y resultan favorecidas.

Diap 7. El estreno de los coronavirus en esto de las emergencias virales tuvo lugar con la pandemia del Severe Acute Respiratory Syndrome (SARS), causado por el SARS- CoV-1 [4]. La enfermedad brotó en Asia en noviembre de 2002 y se dieron casos autóctonos en Canadá y casos importados en Europa, Australia, Estados Unidos y Sudáfrica, lo que justificó técnicamente la consideración de pandemia. Se contabilizaron unos 8.000 casos y unos 900 muertos en los diez meses que duró el brote. El virus se originó en una variante de un coronavirus de murciélagos que alcanzó la especie humana a través de la civeta, que es un vivérrido asiático parecido a nuestra gineta. Pudo aislarse de civetas criadas en granjas pero nunca de civetas salvajes, por lo que las opciones para explicar el salto son tres: en los trabajadores de las granjas; en los mercados en los que se vendían civetas vivas procedentes de las granjas; y en los consumidores de la carne de las civetas criadas en granja. Cualquiera de ellas resulta igualmente probable. Los estudios experimentales han demostrado que la adsorción de su partícula al receptor celular humano era débil, un dato que habla por sí mismo sobre su deficiente grado de adaptación. Eso hace que se requieran muchas partículas infecciosas para infectar una célula y dificulta la transmisión de persona a persona (estadío 3 de la adaptación). El SARS-CoV-1 desapareció a los diez meses de su detección y nunca hasta la fecha ha vuelto a aparecer, lo que lleva a pensar que su tentativa de salto de especie fracasó definitivamente.

Diap 8. El coronavirus del Middle East Respiratory Syndrome (MERS-CoV) se detectó por primera vez en Arabia Saudita en el año 2012. Como el SARS-CoV-1, parece tener su origen en un virus de murciélago y no haber completado con éxito el estadío 2 de su adaptación a los seres humanos, puesto que solo se transmite entre las personas en contextos muy favorables y con bastante dificultad. Los brotes detectados han sucedido siempre en hospitales a través del contacto estrecho entre los sanitarios y los enfermos graves en las unidades de cuidados intensivos. Los casos que se producen esporádicamente fuera de ese entorno se atribuyen a infecciones de animal a persona, originadas en los dromedarios, que suceden en Arabia Saudita y los Emiratos Árabes Unidos. A fecha de agosto de 2019, la OMS declaró haber registrado 2494 casos confirmados de infección por MERS-CoV, con desenlace mortal en 858.
 Diap 9. Los virus de la gripe son virus propios de aves anátidas que se adaptan con facilidad a ciertos mamíferos. Los que alcanzan a nuestra especie suelen proceder de los cerdos. La hemaglutinina (H) y la neuraminidasa (N) son las dos proteínas que el virus usa, respectivamente, para entrar y salir de la célula. Se ubican en la superficie de la partícula y los anticuerpos que protegen contra la infección se dirigen contra ellas. Sin embargo, esos anticuerpos solo cumplen bien su labor para con los virus que portan proteínas del subtipo que indujo su producción, pero mucho peor, o tal vez en absoluto, con las que las llevan de otros subtipos. El virus de la gripe tipo A ha protagonizado cuatro eventos de expansión pandémica conocidos. Gracias al tesón investigador y a la buena fortuna, sabemos por la arqueología microbiológica que el que se desató en 1918 respondió a una cepa del subtipo H1N1. Por lo que sugieren los testimonios de la época sobre la dimensión de aquella epidemia, sospechamos con mucho fundamento que su aparición hubo de comportar cambios en las dos proteínas de superficie respecto de la cepa a la que sustituyó (quizás, un virus que llevaba circulando desde 1890). Ya en la era de la Virología, los dos siguientes eventos pandémicos sucedieron en 1957 y 1968. El primero sustituyó el subtipo H1N1 por el H2N2, lo que trajo otra vez proteínas de superficie nuevas frente a las que no existía inmunidad en la población. La siguiente pandemia sucedió en 1968, cuando un virus de subtipo H3N2 sustituyó por completo al anterior, que desapareció. Ocho años más tarde, el subtipo H1N1 reemergió a partir de un brote en un campamento militar [5], y sin producir en ese momento ningún problema especial ha venido circulando desde entonces junto al subtipo H3N2.
Diap 9. Los virus de la gripe son virus propios de aves anátidas que se adaptan con facilidad a ciertos mamíferos. Los que alcanzan a nuestra especie suelen proceder de los cerdos. La hemaglutinina (H) y la neuraminidasa (N) son las dos proteínas que el virus usa, respectivamente, para entrar y salir de la célula. Se ubican en la superficie de la partícula y los anticuerpos que protegen contra la infección se dirigen contra ellas. Sin embargo, esos anticuerpos solo cumplen bien su labor para con los virus que portan proteínas del subtipo que indujo su producción, pero mucho peor, o tal vez en absoluto, con las que las llevan de otros subtipos. El virus de la gripe tipo A ha protagonizado cuatro eventos de expansión pandémica conocidos. Gracias al tesón investigador y a la buena fortuna, sabemos por la arqueología microbiológica que el que se desató en 1918 respondió a una cepa del subtipo H1N1. Por lo que sugieren los testimonios de la época sobre la dimensión de aquella epidemia, sospechamos con mucho fundamento que su aparición hubo de comportar cambios en las dos proteínas de superficie respecto de la cepa a la que sustituyó (quizás, un virus que llevaba circulando desde 1890). Ya en la era de la Virología, los dos siguientes eventos pandémicos sucedieron en 1957 y 1968. El primero sustituyó el subtipo H1N1 por el H2N2, lo que trajo otra vez proteínas de superficie nuevas frente a las que no existía inmunidad en la población. La siguiente pandemia sucedió en 1968, cuando un virus de subtipo H3N2 sustituyó por completo al anterior, que desapareció. Ocho años más tarde, el subtipo H1N1 reemergió a partir de un brote en un campamento militar [5], y sin producir en ese momento ningún problema especial ha venido circulando desde entonces junto al subtipo H3N2.
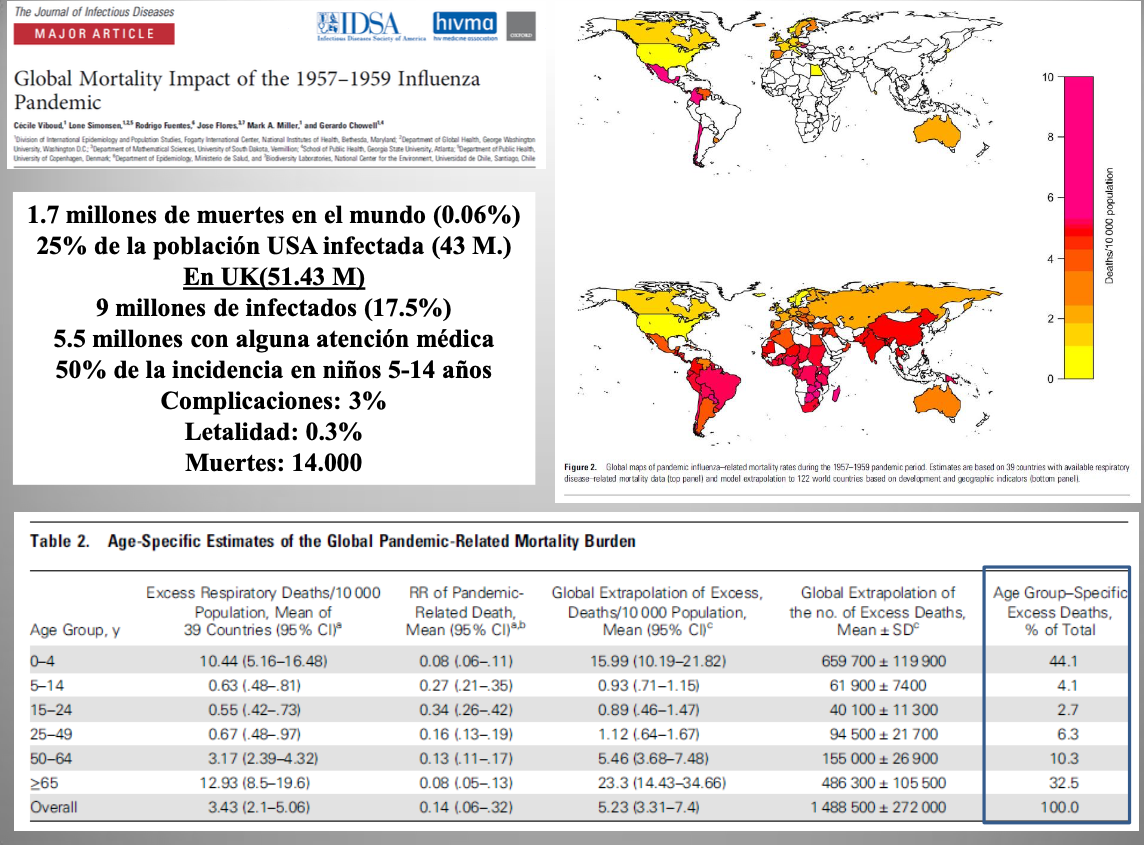
Diap 10. Se calcula que la pandemia del 57 causó 1.7 millones de muertes en todo el mundo, con especial incidencia en los mayores de 65 años y en los niños menores de cuatro [6]. El sistema mundial de vigilancia de la gripe que poseemos hoy se creó algunos años después, así que esa cifra sale de estudiar el exceso en la mortalidad por enfermedad respiratoria que se deduce de los registros de mortalidad general de aquel año. A tenor de esa estimación, la tasa de mortalidad por gripe fue de 567 muertes por millón de habitantes, lo que para los 30 millones de españoles de entonces hubo de suponer unas 18.000 muertes. En la del 68 no cambió el subtipo de la neuraminidasa, y la inmunidad parcial existente (también el uso de la vacuna, ya disponible en algunos lugares) redujo la mortalidad en relación con el episodio anterior.
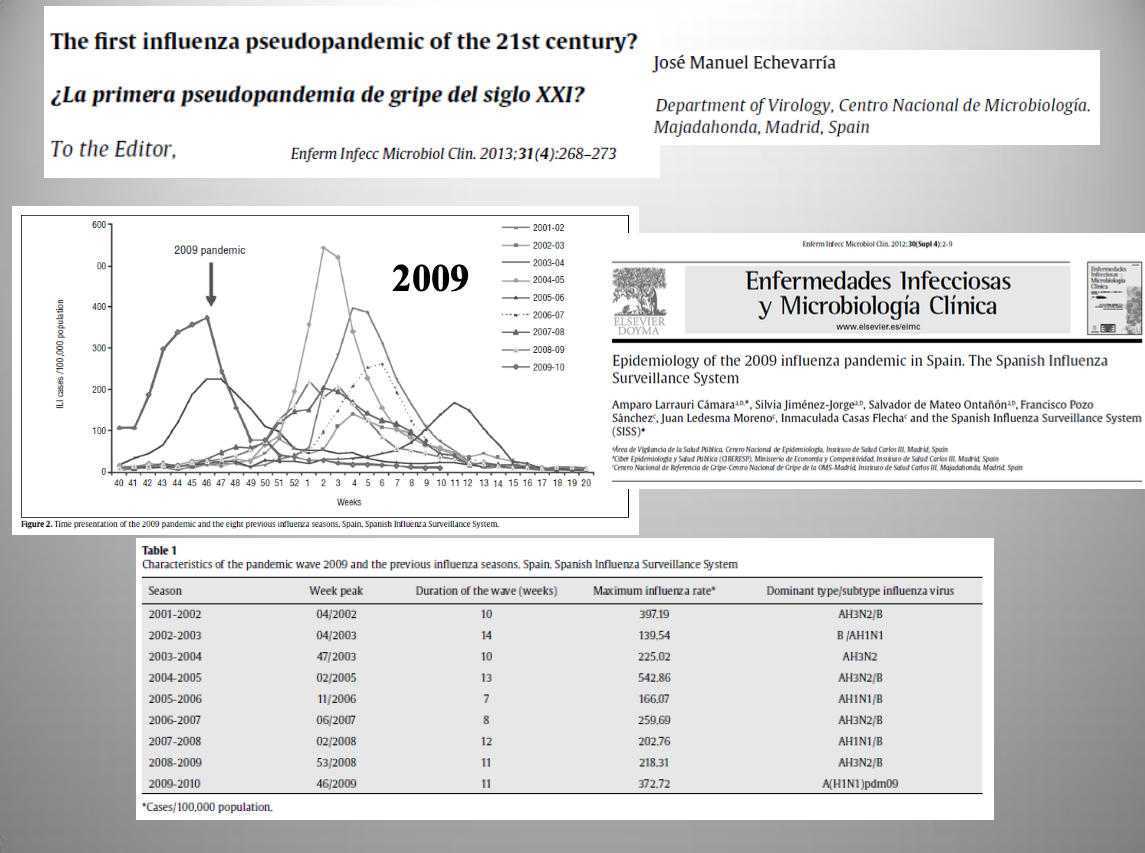 Diap 11. Por último, una cepa nueva del subtipo H1N1, nominada oficialmente como A/H1N1pdm09, protagonizó una pandemia de gripe declarada así oficialmente por la OMS por cumplir los requisitos generales de la definición [7], aunque no introdujese un subtipo de virus nuevo. Al margen de su anormal distribución temporal, infrecuente pero no carente de algún precedente en las temporadas anteriores, la epidemia no destacó por su incidencia y produjo una mortalidad comparativamente muy reducida [8]. El subtipo de gripe A que produce la primera infección en la vida deja una impronta especialmente fuerte en la memoria inmunológica que otorga un alto nivel de protección frente a la reinfección con ese subtipo (inmunidad de “pecado original”). Los nacidos antes de 1957 (mayores de 52 años en 2009) se hallaban en ese caso, lo que podía predecirse desde el primer momento y explica la baja mortalidad que dejó una pandemia gripal que, a mi juicio, fue en realidad una pseudopandemia [9].
Diap 11. Por último, una cepa nueva del subtipo H1N1, nominada oficialmente como A/H1N1pdm09, protagonizó una pandemia de gripe declarada así oficialmente por la OMS por cumplir los requisitos generales de la definición [7], aunque no introdujese un subtipo de virus nuevo. Al margen de su anormal distribución temporal, infrecuente pero no carente de algún precedente en las temporadas anteriores, la epidemia no destacó por su incidencia y produjo una mortalidad comparativamente muy reducida [8]. El subtipo de gripe A que produce la primera infección en la vida deja una impronta especialmente fuerte en la memoria inmunológica que otorga un alto nivel de protección frente a la reinfección con ese subtipo (inmunidad de “pecado original”). Los nacidos antes de 1957 (mayores de 52 años en 2009) se hallaban en ese caso, lo que podía predecirse desde el primer momento y explica la baja mortalidad que dejó una pandemia gripal que, a mi juicio, fue en realidad una pseudopandemia [9].
La pandemia del SARS-CoV-2

Diap 12. Nos hallamos inmersos en este momento en la última emergencia viral de la lista, la protagonizada por el coronavirus conocido como COVID19 cuyo nombre será, en nomenclatura oficial, SARS-CoV-2. El virus brotó en una provincia del suroeste de China en noviembre de 2019, y tras extenderse en Asia, principalmente a Japón, Corea del Sur, Singapúr y Taiwan, se movió hacia el oeste estableciendo dos focos secundarios de expansión: uno en Irán y, unos días más tarde, otro en el norte de Italia. Parece muy probable que su origen esté, una vez más, en un coronavirus de los muchos que infectan a los murciélagos [10]. Tal vez el pangolín malayo haya jugado ahora el mismo papel de especie puente que jugó la civeta con el SARS-CoV-1, pero esto es, por ahora, solo una especulación.

Diap 13. Es aún muy pronto para dibujar una descripción válida de esta nueva pandemia por cuanto que sospechamos con mucho fundamento que las cifras de infectados que manejamos ahora están muy alejadas de la realidad (tal vez grotescamente alejadas, como veremos después). No obstante, considerarlas no es inútil porque sí sirven para hacernos una idea general sobre quién es este nuevo virus. Así, basta mirar el mapa de distribución confeccionado por la OMS a 27 de marzo, y considerar las cifras oficiales a esa fecha, para concluir que las semejanzas entre los SARS-CoV 1 y 2 son prácticamente nulas. No cabe ya dudar de que nos hallamos ante un nuevo coronavirus respiratorio bien adaptado a nuestra especie que protagoniza ahora su primera expansión pandémica, como antaño lo hicieron cada una de las más de 120 especies de virus respiratorios que nos vistan cada año, unos agentes tan diversos que los clasificamos dentro de ocho familias de virus diferentes. Parece tratarse, pues, del quinto coronavirus humano que tendremos que tomar en consideración todas las temporadas de otoño-invierno a partir de ahora, porque lo cierto es que ya tenemos cuatro bien asentados entre nosotros.

Diap 14. Antes de aventurarse en el juego de las cifras, es esencial fijar estos conceptos básicos del análisis epidemiológico de las enfermedades infecciosas. Las dos reglas de oro nos enseñan que, muy probablemente, contando enfermos y estudiando sus contactos rara vez nos acercaremos mucho a conocer la realidad. Por su parte, los conceptos de prevalencia, mortalidad y letalidad nos enseñan a expresar las cifras brutas en términos dotados de significado, permitiéndonos establecer comparaciones que realmente nos enseñen algo. Sin tener esos conceptos claros, el juego de las cifras no es más que una pura fiesta de la confusión.
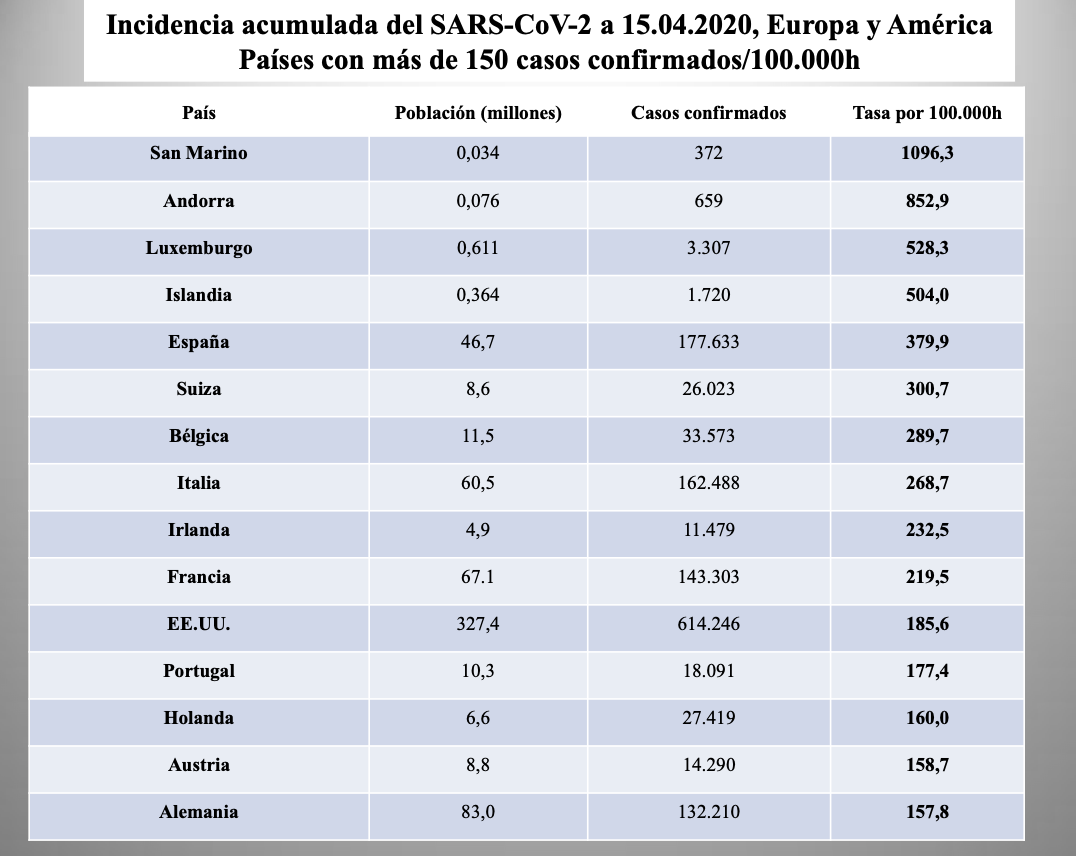
Diap 15. El primer ejercicio que debemos hacer para explotar los números que tenemos es, por consiguiente, convertirlos en tasas acumuladas de incidencia (casos/100.000h desde el inicio). Con esa primera corrección, la estimación de lo sucedido en esos diez países a fecha 27 de marzo cambia bastante y nos acerca mejor a la realidad comparativa. La primera sorpresa viene de mirar los cuatro primeros puestos del ranking. La segunda, que los apabullantes 614.246 casos de los EEUU envíen a ese país al undécimo puesto. Por desgracia, España ocupa el primero entre los países que cuentan su población por millones de habitantes, tres puestos por delante de Italia. Enseguida veremos que si colocásemos en esta tabla a la Comunidad de Madrid ocuparía el tercer puesto.
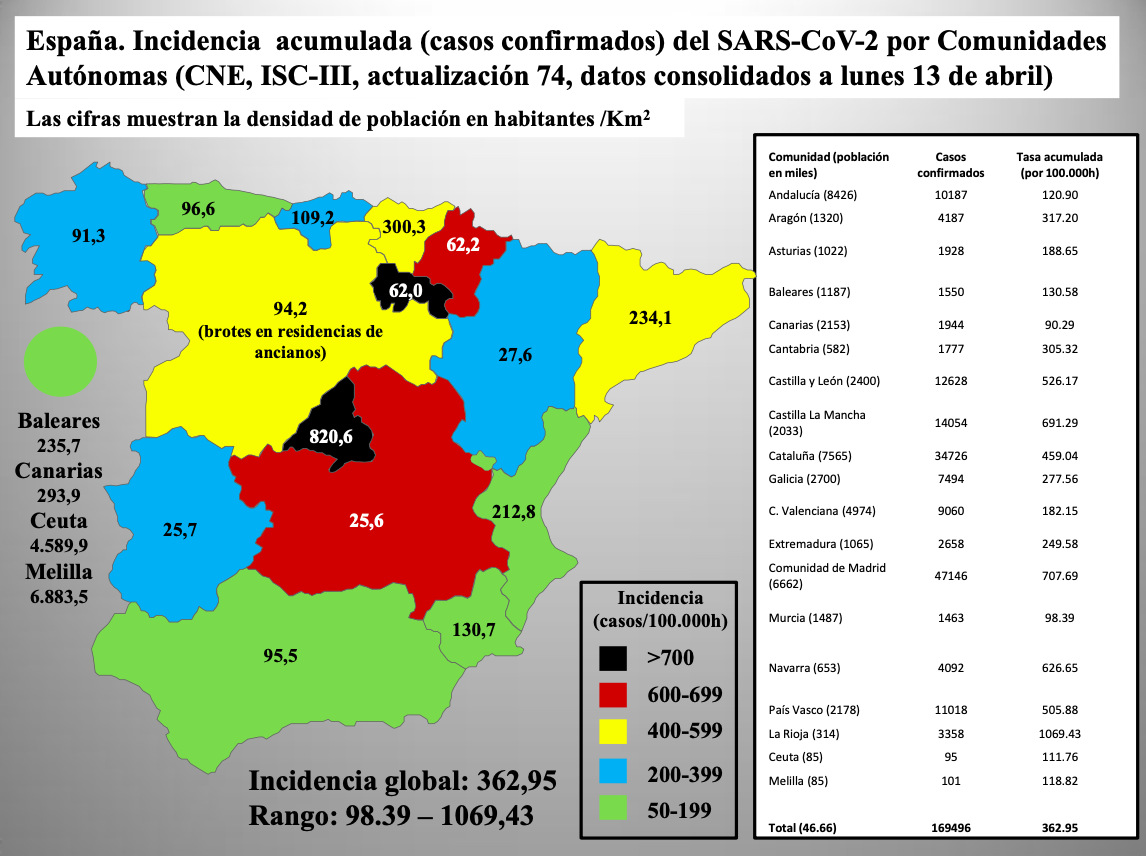
Diap 16. Aplicando el ejercicio a comparar entre sí las situaciones de nuestras Comunidades Autónomas, se comprueba que los agentes infecciosos no entienden ni comparten nuestros conceptos de país, nación o estado. Madrid se revela entonces como uno de los rincones del mundo más castigados por la epidemia. Además, añadiendo el dato de la densidad de población parece sugerirse cierta correlación con la incidencia. El caso de La Rioja es un cisne negro que tiene su explicación en la particular forma en la que se inició la epidemia allí.

Diap 17. Como yo no soy bueno ni con los Excel ni con las ecuaciones, mi hijo me ayudó a contrastar la hipótesis de la densidad de población. En esa gráfica parece insinuarse cierta correlación directa a partir de los 100 habitantes/Km2 , pero nunca se consiguen valores de R2 que merezca la pena considerar. La hipótesis tiene sentido con un virus de transmisión respiratoria, pero o bien no se satisface en este caso, o bien existen otras variables a considerar (variables de confusión) que se superponen y ocultan el hecho. Quizá con datos de mejor calidad se obtenga en el futuro un resultado mejor.




Diap 18-22. Y hablando de la calidad de los datos, ya es hora de hacerse algunas preguntas. ¿Qué significa “casos confirmados”? ¿Significa lo mismo en España que en Alemania? ¿Cómo se diagnostica la infección? ¿Se hace igual en todas partes? ¿Cómo se cuentan las víctimas mortales? ¿Se cuentan igual en España que en Alemania? La cuestión es que nada de esto está acordado y protocolizado fuera de los ámbitos nacionales (cuando lo esté realmente en ese ámbito). Por consiguiente, analizar las diferencias entre las series para buscarles explicación queda sujeto a importantes incertidumbres que no pueden resolverse, lo que nos impide salir del escurridizo terreno de las conjeturas. En cuanto al comentario sobre la asignación de muertes, el coronavirus que se cita en el estudio realizado en Navarra en 2018 no es, naturalmente, el SARS-CoV-2.
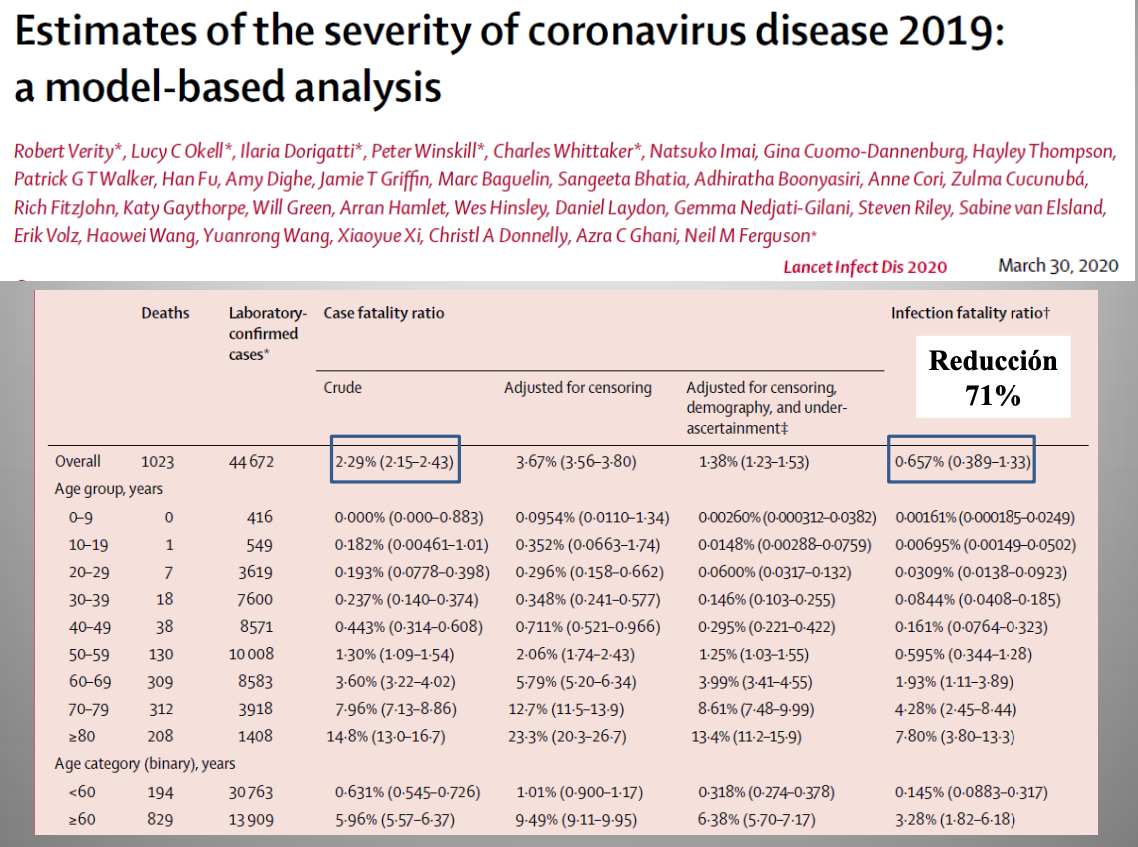
Diap 23. La inusualmente alta letalidad que asignaban al virus las cifras oficiales llevó a muchos expertos a dudar de la validez del numerador de la fracción; es decir, del número de casos de infección al que, supuestamente, correspondían esas muertes. Partiendo de la letalidad hallada en China sobre más de 44.500 casos confirmados, el Trinity College de Londres hizo entonces una primera aproximación estadística para calcular correcciones, y fue así que redujo la letalidad de la serie del 2,29% que salía originalmente al 0.66% que resultaba de la corrección, lo que representa una reducción del 71%. Así pues, el numerador real no sería, en números redondos, 44.500 (los casos confirmados) sino 155.000. Este importante aviso se publicó en una excelente revista médica el 30 de marzo de 2020 [11], aunque se dio a conocer mucho antes.

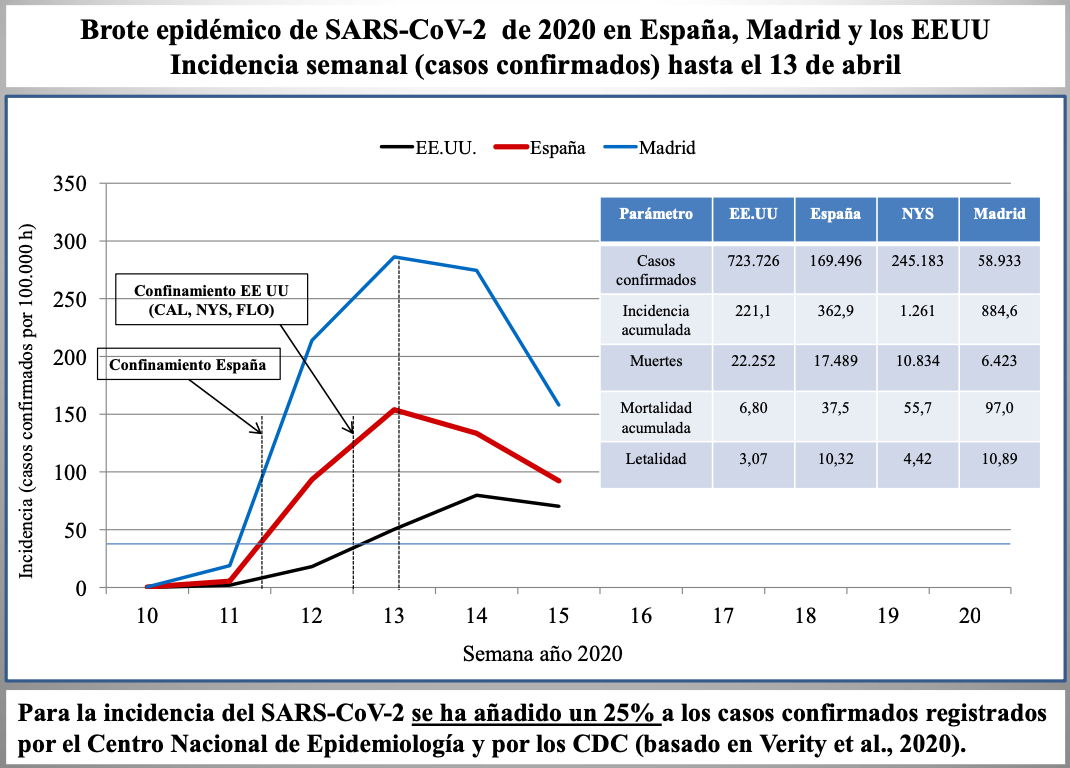
Diap 24. Si ahora convertimos las cifras semanales de casos confirmados a fecha 13 de abril, incrementándolas en un muy prudente 25% según lo anterior, en tasas de incidencia por semanas, dibujaremos unas curvas de evolución de la epidemia que nos permitirán comparar lo sucedido hasta entonces en España, la Comunidad de Madrid y los EEUU. Se deduce de las curvas que las tasas de España y los EEUU eran muy semejantes cuando en uno y otro país se implantaron medidas de confinamiento de la población en el hogar (en el segundo caso, solo en tres estados). En el caso español, la incidencia en la Comunidad de Madrid ya doblaba en ese momento la del conjunto de España. En el pico de las curvas españolas, que se alcanzó 12-13 días después del confinamiento, la proporción entre Madrid y España había cambiado poco, mientras que la de los EEUU mantenía su ascenso. La incidencia acumulada en Madrid a 13 de abril multiplicaba por 2,4 la acumulada en España, y la acumulada en el estado de Nueva York multiplicaba por 5,7 la del conjunto de los EEUU. Algo parecido sucedía con las tasas de mortalidad (2,6 y 8,2, respectivamente). En cuanto a la letalidad, la de España era 3,4 veces la de EEUU y la de Madrid era 2,5 veces la de Nueva York.
Diap 25. En todo caso, ¿qué suponen esas cifras? Si las comparamos con algo tan bien conocido y estudiado como la gripe estacional, podremos hacernos una idea. Usando los datos disponibles para la temporada de gripe 2019-20, se diría que, hasta ese momento (sexta semana), la evolución global de la epidemia del SARS-CoV-2 no difería demasiado, en términos de incidencia semanal, de la que ofrecía la gripe en su sexta semana. Sin embargo, algo suena muy mal cuando introducimos los fallecimientos en la comparación usando los datos del informe emitido por el Sistema de Vigilancia de la Gripe en España (SVGE) para la temporada 2018-19 [12] (los de la temporada 2019-20 aún no se han publicado): unos 17.500 para el coronavirus en seis semanas frente a unos 6.300 para la gripe en 10 semanas. La tasa de letalidad del primero (10,32% a 13 de abril, 17.489 muertos/169.496 casos confirmados) multiplica por ocho la del segundo (1.29%, 6.300 muertos/490.000 casos estimados para la temporada completa). ¿Puede un coronavirus respiratorio bien adaptado al ser humano ser más de ocho veces más letal que un virus de la gripe tipo A? ¿No será, tal vez, que tenemos un problema con nuestro denominador; que en lugar de 170.000 infectados por SARS-CoV-2 ya había, en realidad, alrededor de un millón y medio? ¿Quizás el SVGE, cuando atribuye una muerte a la gripe, no sigue el mismo criterio que el que seguimos ahora para atribuir una muerte al coronavirus? ¿Pasarán ambas cosas a la vez?
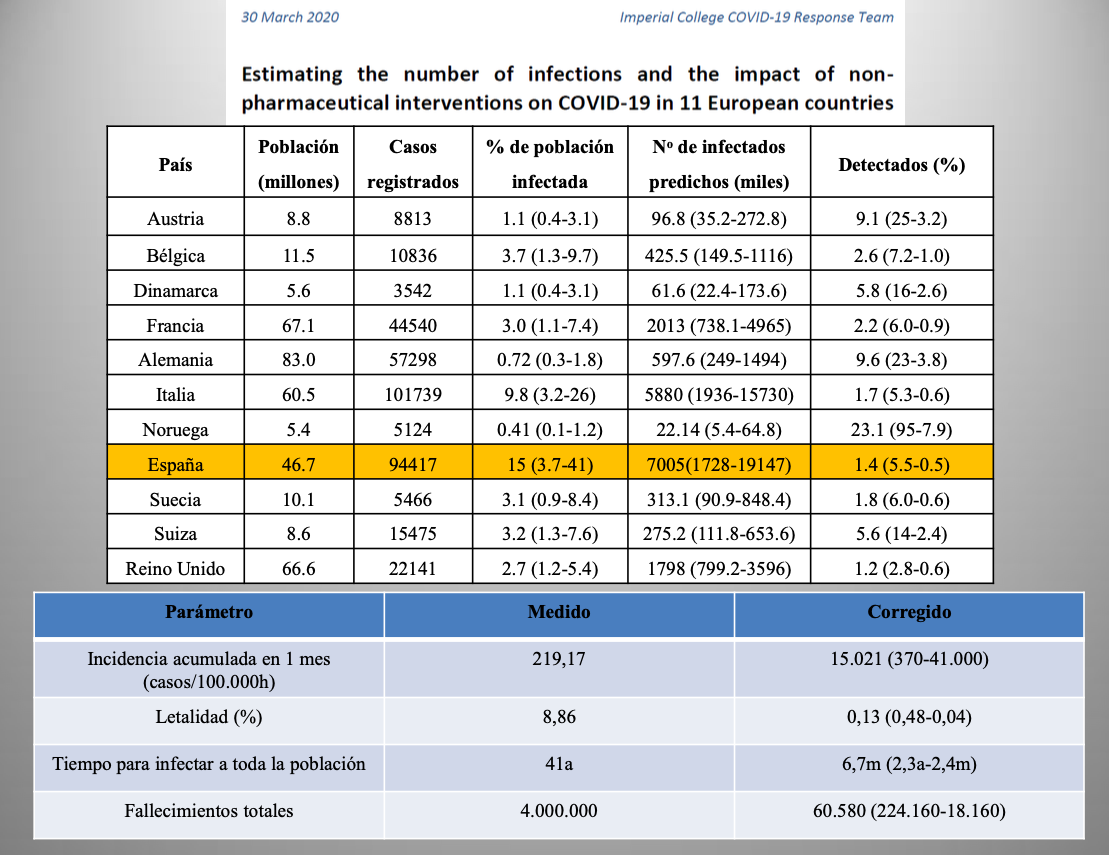
Diap 26. Prosiguiendo con su trabajo de corrección de las cifras, el Imperial College se basó en su estudio anterior para desarrollar un modelo matemático de la epidemia sobre la base de los datos disponibles a 30 de marzo para 11 países europeos, que sumaban entre todos 329.301 casos confirmados [13]. En el caso de mayor precisión del modelo, los 5.124 casos confirmados en Noruega se corrigieron a 22.140 (0,41% de la población), con límites de confianza al 98% entre 5.400 y 64.800 (0.1 a 1.2%). En el caso de España, los 94.417 casos confirmados se corrigieron a 7.005.000 (15% de la población), con límites de confianza entre 1.728.000 y 19.147.000 (3,7 a 41%). Con ese valor predicho, la incidencia acumulada a esa fecha pasaba de 219,17 a 15.021 infectados/100.000h, y la letalidad se reducía de 8,86 a 0,13% (rango: 0,48 a 0,04%). Los nuevos datos de esta prestigiosa institución incrementaron la sensación de estar manejando cifras de infectados no ya alejadas de la realidad, sino grotescamente alejadas de ella (en el mejor de los casos, los 94.417 casos de España representarían un 5,5% de los infectados reales; y en el peor, un 0.5%).
Diap 27-29. Los tres gráficos que siguen muestran la incidencia semanal de casos de infección en España según tres modelos: la corrección al alza en un 25% ya vista antes (modelo 1); la corrección según el límite inferior del intervalo de confianza al 98% predicho por el Imperial College (modelo 2); y la misma corrección pero tomando directamente el valor predicho (modelo 3).
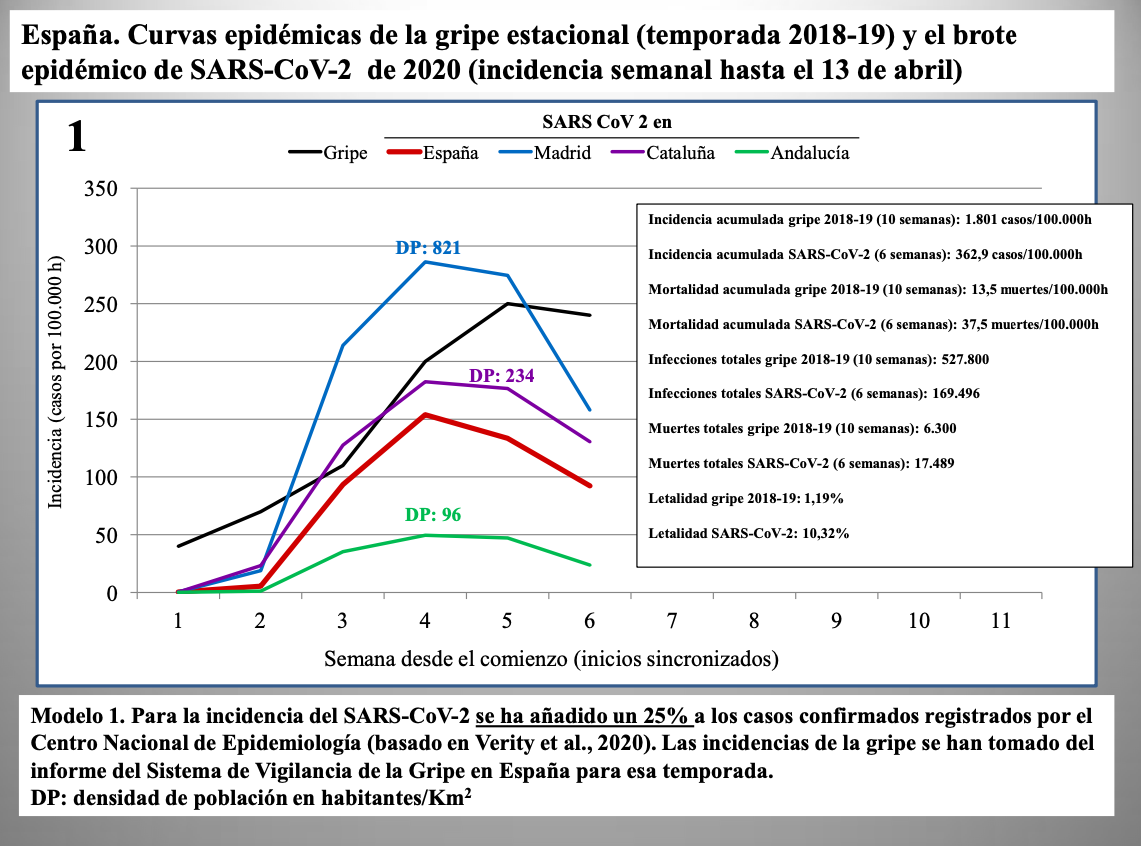
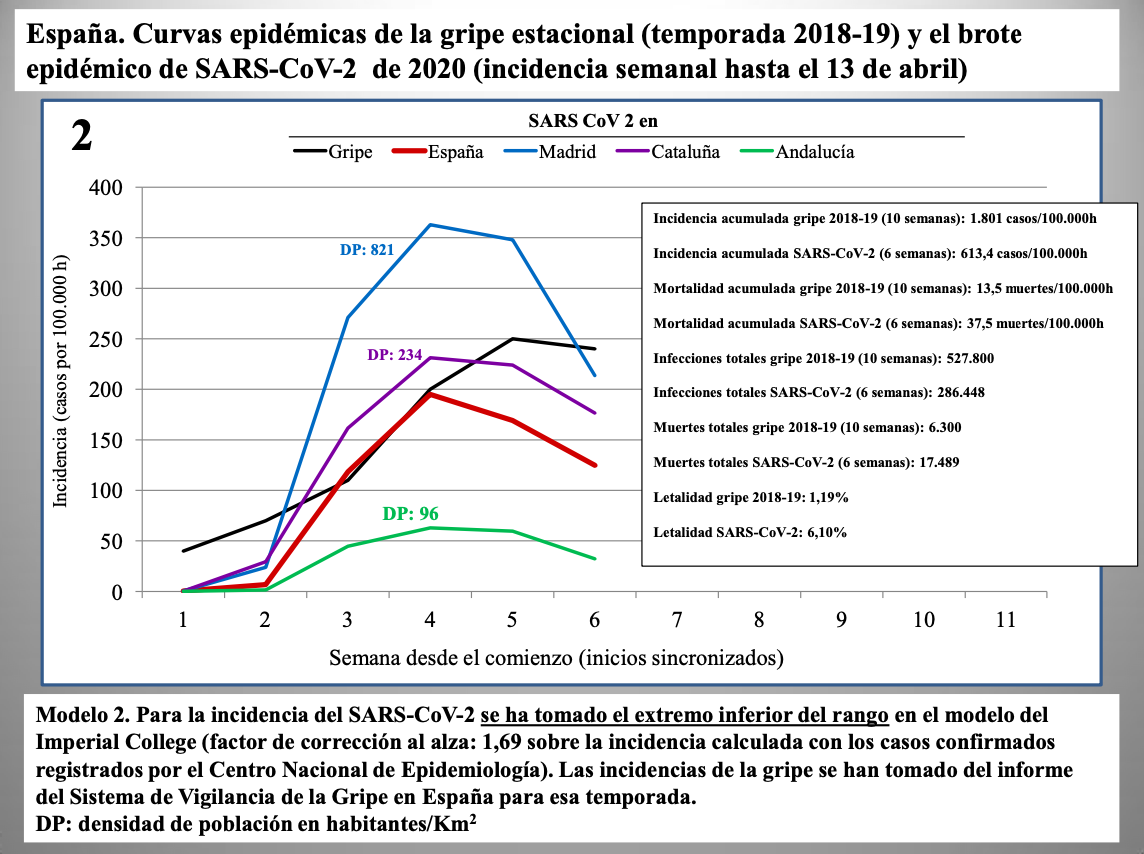
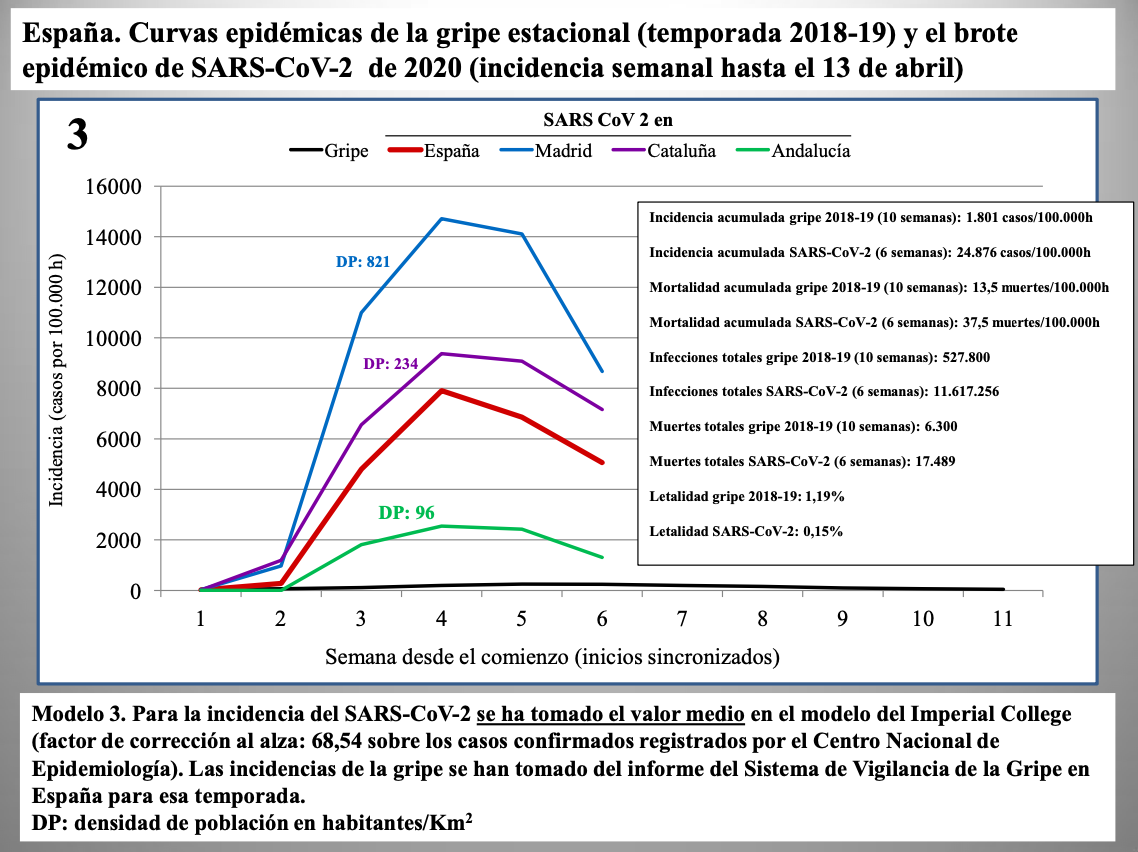 Se usa en todos los casos la incidencia semanal de la gripe de 2018-19 como término de comparación, sincronizando el comienzo de las epidemias para mejorar la comparación visual. En el modelo 3, las cifras del SARS-CoV-2 se disparan tanto que la curva de la gripe desaparece, prácticamente, del gráfico.
Se usa en todos los casos la incidencia semanal de la gripe de 2018-19 como término de comparación, sincronizando el comienzo de las epidemias para mejorar la comparación visual. En el modelo 3, las cifras del SARS-CoV-2 se disparan tanto que la curva de la gripe desaparece, prácticamente, del gráfico.
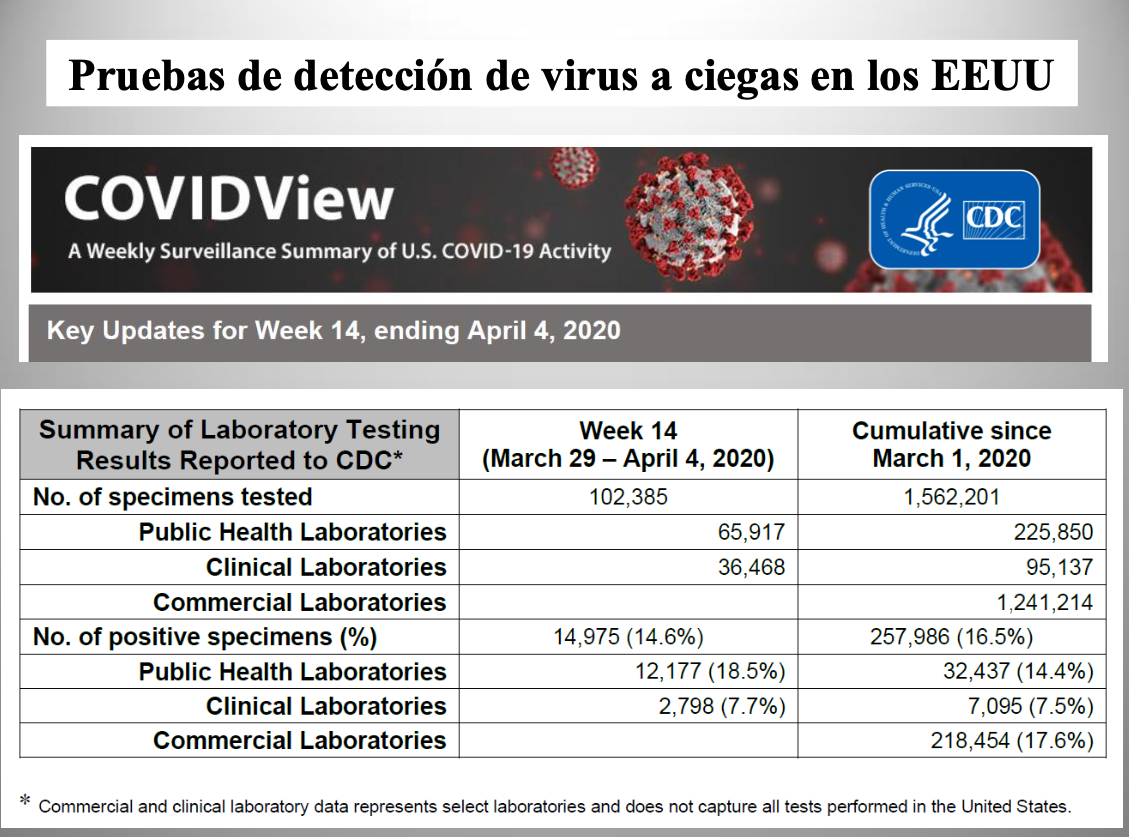 Diap 30. La realización de pruebas de detección de virus en grandes cantidades, aunque sin planificación alguna, está ya sucediendo en los EEUU, y los CDC han recogido en un informe los resultados obtenidos de más de un millón y medio de pruebas realizadas entre el 1 de marzo y el 4 de abril. El hecho de que el 80% de ellas se realizasen en laboratorios privados pone de manifiesto la ausencia de planificación y la total carencia de representatividad de la muestra y de los resultados. Con todo, el hecho de que el 16.5% de las pruebas fuesen positivas no carece de interés, puesto que la prueba identifica personas con infección activa adquirida dentro de, aproximadamente, la semana anterior a la toma de la muestra. A 15 de abril, la cifra de casos confirmados en los EEUU era de 614.246, lo que representa el 0.19% de la población del país. Aunque la naturaleza del dato sea completamente anárquica, viene a abundar en la idea de que las cifras oficiales de casos confirmados deben representar menos del 10% de los infectados reales.
Diap 30. La realización de pruebas de detección de virus en grandes cantidades, aunque sin planificación alguna, está ya sucediendo en los EEUU, y los CDC han recogido en un informe los resultados obtenidos de más de un millón y medio de pruebas realizadas entre el 1 de marzo y el 4 de abril. El hecho de que el 80% de ellas se realizasen en laboratorios privados pone de manifiesto la ausencia de planificación y la total carencia de representatividad de la muestra y de los resultados. Con todo, el hecho de que el 16.5% de las pruebas fuesen positivas no carece de interés, puesto que la prueba identifica personas con infección activa adquirida dentro de, aproximadamente, la semana anterior a la toma de la muestra. A 15 de abril, la cifra de casos confirmados en los EEUU era de 614.246, lo que representa el 0.19% de la población del país. Aunque la naturaleza del dato sea completamente anárquica, viene a abundar en la idea de que las cifras oficiales de casos confirmados deben representar menos del 10% de los infectados reales.
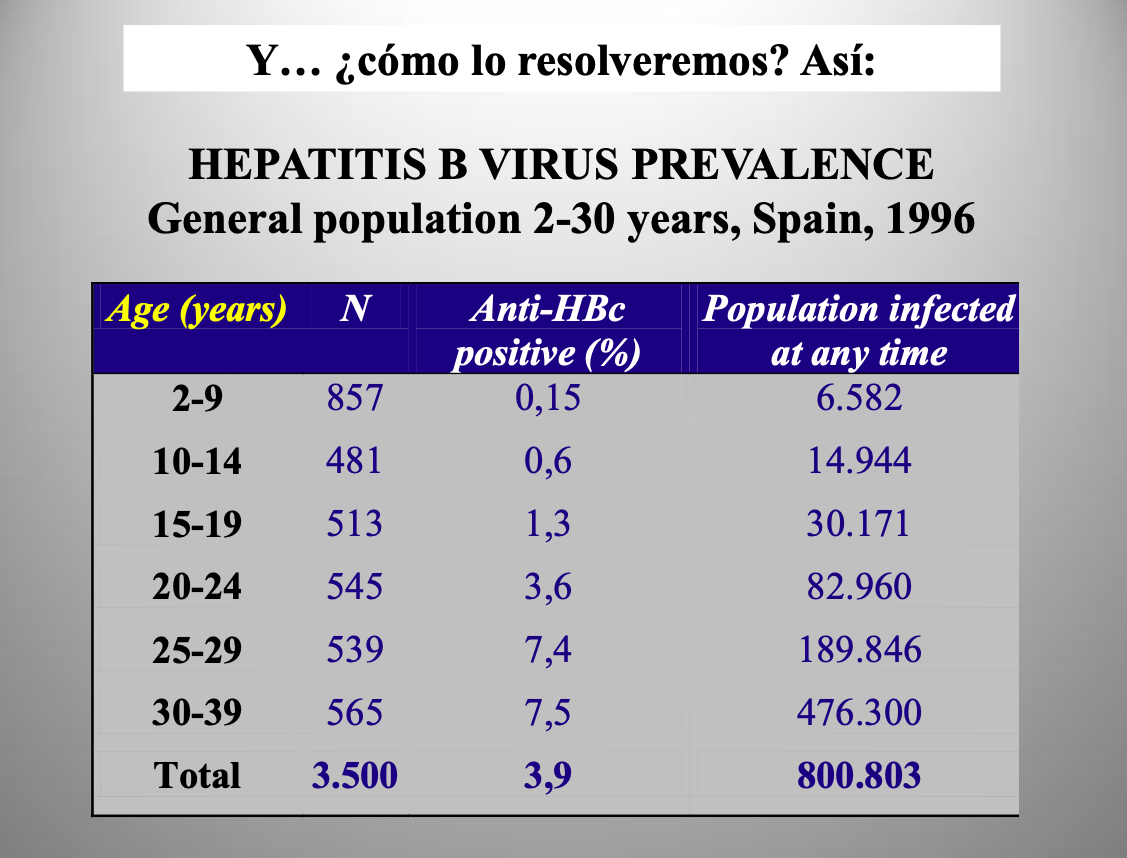
Diap 31. Si de verdad deseamos conocer la realidad en la que vivimos, resolver satisfactoriamente esas enormes incertidumbres es tan urgente como posible sin gran dificultad. La herramienta a usar se conoce como “encuesta de seroprevalencia”, y la tabla que se reproduce demuestra cómo respondió a esa pregunta hace 24 años en relación al virus de la hepatitis B en España. Bastó estudiar 3.500 muestras, debidamente planificadas, mediante la prueba adecuada de detección de anticuerpos (no de virus) para concluir con mucha base que existían en ese momento en el país unas 800.000 personas que se habían infectado con el VHB en algún momento de su vida, e incluso para concluir que las infecciones sucedían fundamentalmente a partir de la adolescencia. El Ministerio de Sanidad anunció hace unos días la intención de realizar un estudio de esa clase para el SARS-CoV-2 a la mayor brevedad. Se mencionó estudiar 60.000 muestras, lo que significa que se pretende que los resultados sean representativos por comunidades autónomas, por edades y por sexos. Por el momento, solo pueden citarse los resultados (enviados a publicación) de un estudio realizado por la universidad de Stanford en el condado de Santa Clara, California [14]. De ellos, los autores concluyen que el número de personas ya infectadas a 1 de Abril es entre 50 y 85 veces superior al de casos confirmados contabilizados en esa región, situando la letalidad de la infección en el rango de 0,12-0,2%. El artículo cita datos similares no publicados para las localidades de Robbio (Italia) [15] y Gangelt (Alemania) [16].
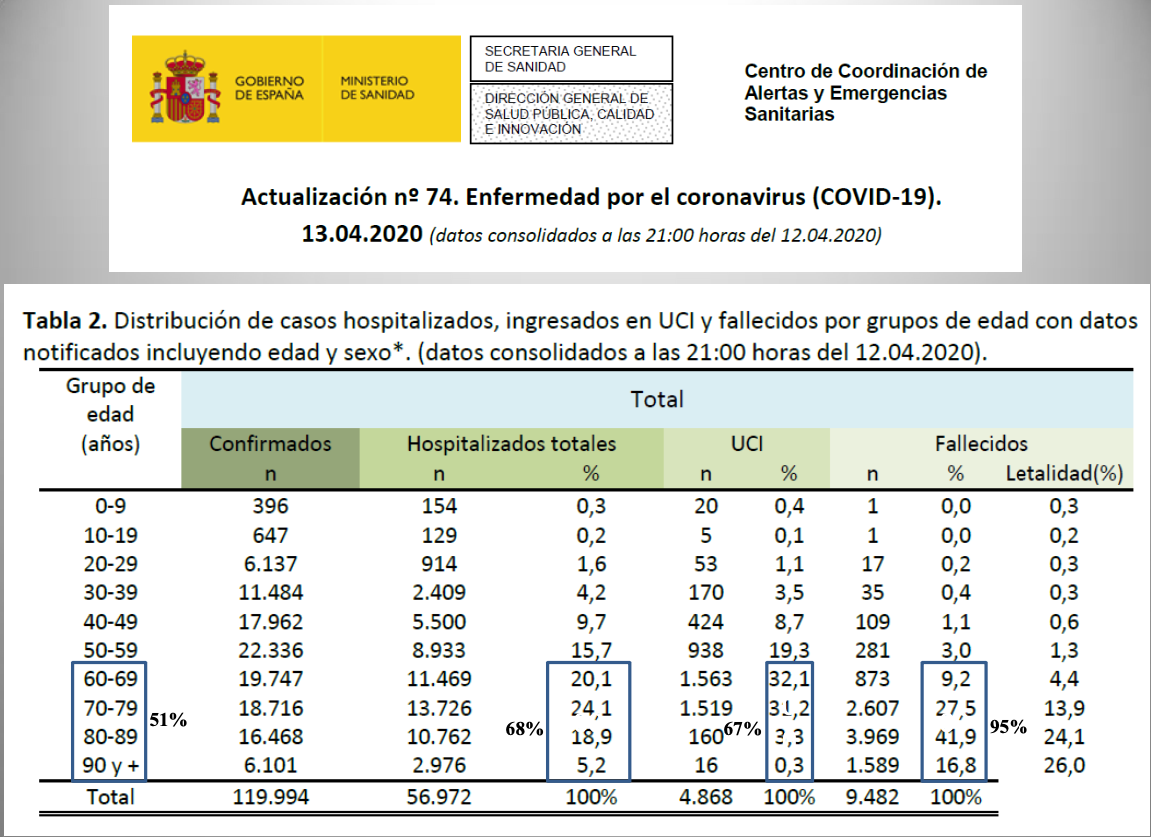
Diap 32. Con ese nuevo conocimiento en nuestras manos, las tasas de hospitalización, ingreso en UCI y muerte que corresponden a este virus serán, con total seguridad, muy inferiores a las que manejamos ahora, entre diez y cincuenta veces menos. En términos de población, nos revelarán dos cosas importantes: 1. Que el problema sanitario que plantea este virus ahora no tiene que ver con una especial capacidad para producir enfermedad grave, sino con estar infectando a mucha gente en muy poco tiempo a causa de nuestra carencia de inmunidad de grupo en estos primeros compases de su expansión; 2. Que una vez alcancemos un cierto umbral de inmunidad de grupo, que yo estimo en torno al 50-60%, este virus pasará a ser un virus respiratorio más que de ninguna forma planteará un problema sanitario de la envergadura del que plantea la gripe, sino que será notablemente menor. En términos individuales, que el riesgo individual de sufrir un problema serio con el SARS-CoV-2 tiene que ver esencialmente con la edad, si bien las nuevas cifras lo situarán en tasas muy inferiores a las actuales.
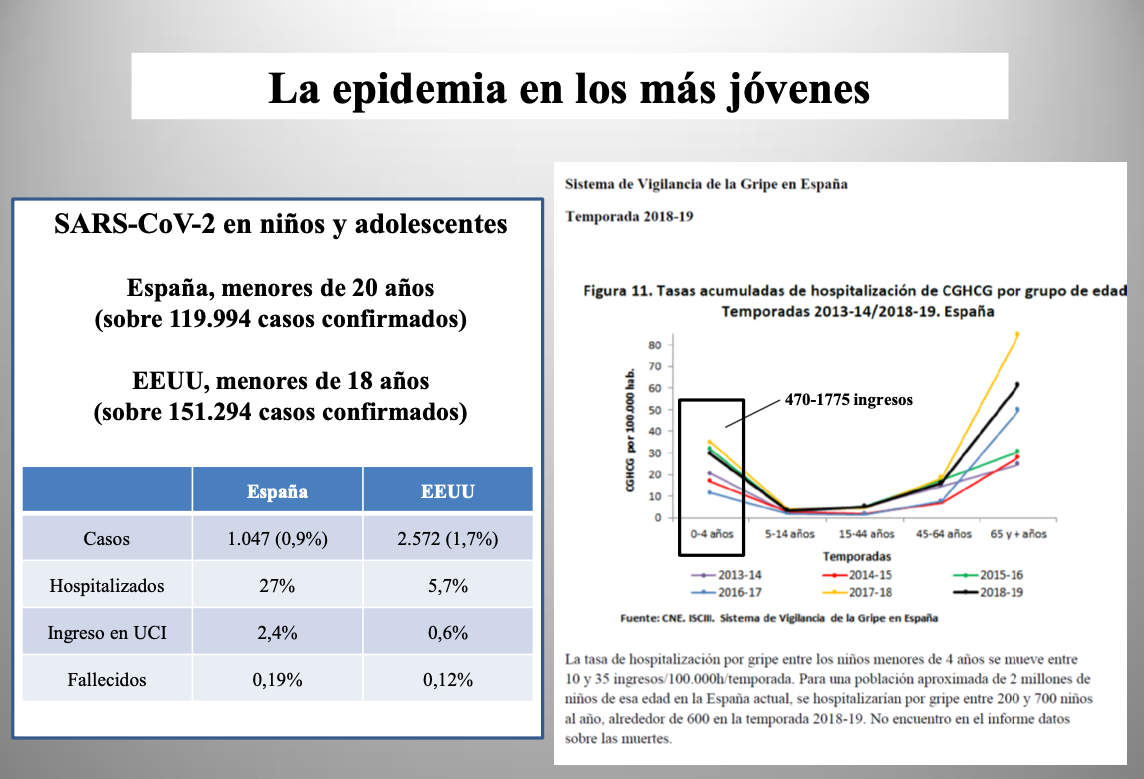 Diap 33. Un aspecto muy a destacar en este punto de la gravedad de la infección es que la salud de los niños y los adolescentes apenas se ve afectada por el SARS-CoV-2, como se desprende de las cifras de hospitalización, ingreso en UCI y fallecimiento disponibles en España y los EEUU para los menores de 20 o 18 años, respectivamente. Incluso en esta fase inicial de expansión pandémica, en la que las infecciones por SARS-CoV-2 pueden haber multiplicado ya por diez o más las que provocan los virus de la gripe estacional en una temporada, las hospitalizaciones en niños y adolescentes entran dentro del rango de las que suceden en una temporada gripal cualquiera solo entre los niños menores de cuatro años. Pasada esta fase, quedarán muy por debajo del límite inferior del rango.
Diap 33. Un aspecto muy a destacar en este punto de la gravedad de la infección es que la salud de los niños y los adolescentes apenas se ve afectada por el SARS-CoV-2, como se desprende de las cifras de hospitalización, ingreso en UCI y fallecimiento disponibles en España y los EEUU para los menores de 20 o 18 años, respectivamente. Incluso en esta fase inicial de expansión pandémica, en la que las infecciones por SARS-CoV-2 pueden haber multiplicado ya por diez o más las que provocan los virus de la gripe estacional en una temporada, las hospitalizaciones en niños y adolescentes entran dentro del rango de las que suceden en una temporada gripal cualquiera solo entre los niños menores de cuatro años. Pasada esta fase, quedarán muy por debajo del límite inferior del rango.
La respuesta de las autoridades en Europa

Diap 34. Pude decirse que todos los gobiernos del mundo han ido tomando medidas de diferentes naturalezas y alcances para combatir la dispersión del SARS-CoV-2, especialmente después de que la OMS llamase a implantar una estrategia de eliminación del virus tras declarar la pandemia el día 11 de marzo. Al margen del objetivo propuesto por la OMS, que unos gobiernos atendieron y otros no, todos buscaron en alguna medida que sus hospitales, y muy especialmente las unidades de cuidados intensivos, no quedasen colapsados por la afluencia de muchos pacientes en un espacio de tiempo muy corto. Para analizar esta cuestión, he clasificado las medidas en tres grados de menor a mayor severidad, aunque las del grado 1 incluyen paquetes diversos que buscan esencialmente reducir los contactos muy próximos entre las personas. Las medidas más severas han requerido declarar estados de alarma o excepción que suspenden temporalmente algunos derechos constitucionales de los ciudadanos, lo que en algunos países ha suscitado dudas sobre su posible inconstitucionalidad entre los juristas especializados. Recientemente, la presidencia de la Comisión Europea ha llamado la atención sobre este punto, instando a los gobiernos que las han implantado a no prolongarlas durante mucho más tiempo.
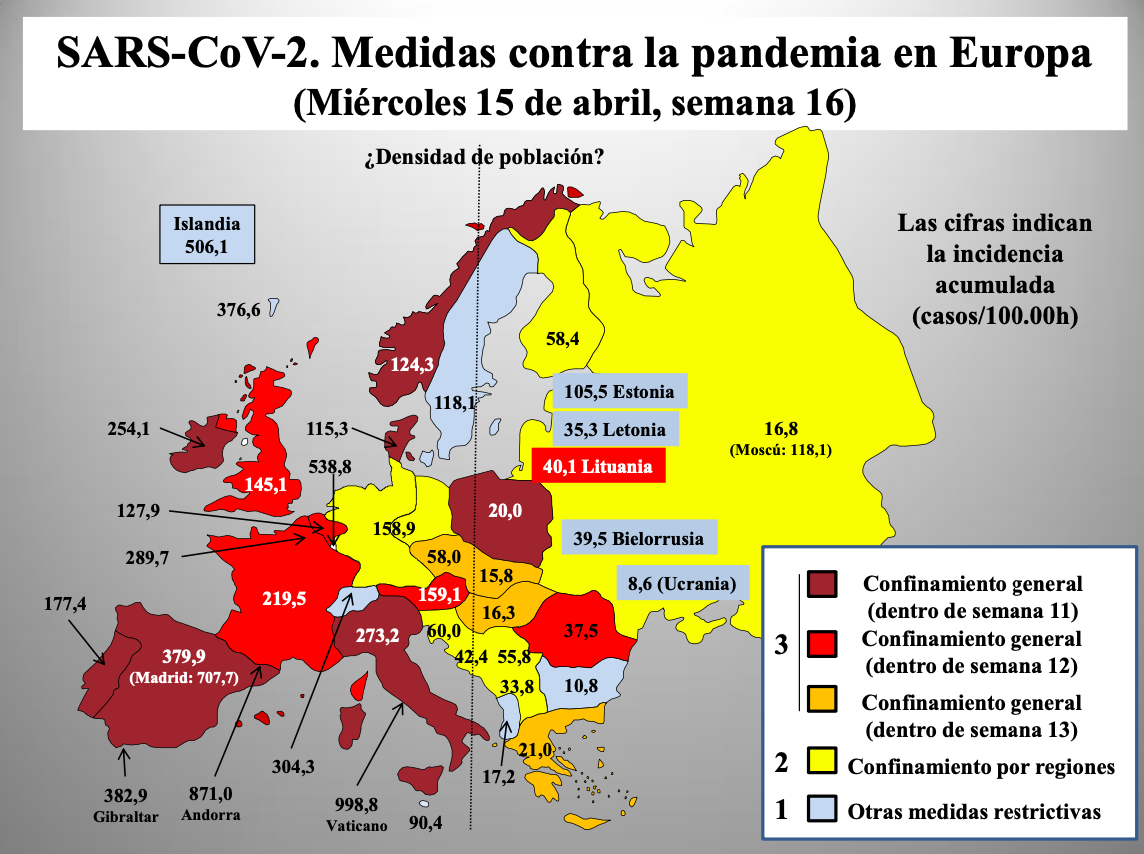

Diap 35 y 36. Entre los días 9 y 28 de marzo (semanas 11-13 del año), 11 países europeos optaron por implantar medidas de grado 3. Diez países escogieron diferentes paquetes dentro del grado 1, mientras que en los restantes se adoptaron medidas de grado 2. Transcurridas cinco semanas desde que se iniciaron las intervenciones, las cifras de incidencia acumulada no parecen mostrar una correlación clara con el grado de severidad de las medidas, lo que pone en duda su eficacia. De hecho, el análisis estadístico que se muestra en la gráfica no muestra correlación alguna. Hay que destacar que este intento de contener la expansión de un virus respiratorio mediante el confinamiento de la población no tiene precedentes conocidos, por lo que su eficacia solo puede teorizarse. Se apela como justificación su supuesto éxito en China, Taiwan y Corea del Sur, pero en ausencia de publicaciones científicas que describan esas experiencias en detalle, para poder someterlas al necesario examen previo a debate, todo queda en confiar en las informaciones oficiales que proporcionan los gobiernos de esos países. Al menos las del principal de ellos han sido puestas en entredicho repetidas veces.

Diap 37. A día de hoy, resulta evidente que el objetivo de eliminación propuesto originalmente por la OMS es ya una quimera. En cuanto a otros objetivos, es necesario contraponer dos hechos muy claros: 1. La saturación de las unidades de cuidados intensivos obliga necesariamente a seleccionar a los pacientes que ocuparán esas camas, y esa necesaria selección eleva las cifras de muertes atribuibles al virus; 2. El deterioro de la actividad productiva que aparejan las medidas más severas generará una crisis económica, las crisis económicas aumentan la pobreza, la pobreza causa sufrimiento y muertes, y esas muertes no podrán atribuirse al virus puesto que derivarán de las consecuencias de unas medidas libremente adoptadas cuya eficacia era en realidad desconocida. Mientras que las primeras víctimas se contabilizan fácilmente mediante pruebas de laboratorio, contabilizar las segundas es, obviamente, mucho más difícil y mucho menos inmediato. Sin embargo, el derecho a la vida ampara a todos por igual, y actuar con humanidad y justicia exige que los dos platos de esa balanza no queden desequilibrados. En un esfuerzo por cuantificar el peso de ese segundo plato, un modelo matemático desarrollado recientemente [17] ha estimado que cualquier descenso mayor del 6,4% en el PIB per capita de un país trae más muertes a ese país que las derivadas de la libre circulación del virus, concentrándose además en el 10% más pobre de la población e incidiendo en todos sus segmentos de edad. Esas parecen ser, por consiguiente, las condiciones de este difícil balance, en el que la responsabilidad que enfrentan los responsables políticos va mucho más allá de causarnos ahora más o menos incomodidades a los ciudadanos o de salvar más o menos vidas aquí y en este preciso momento.
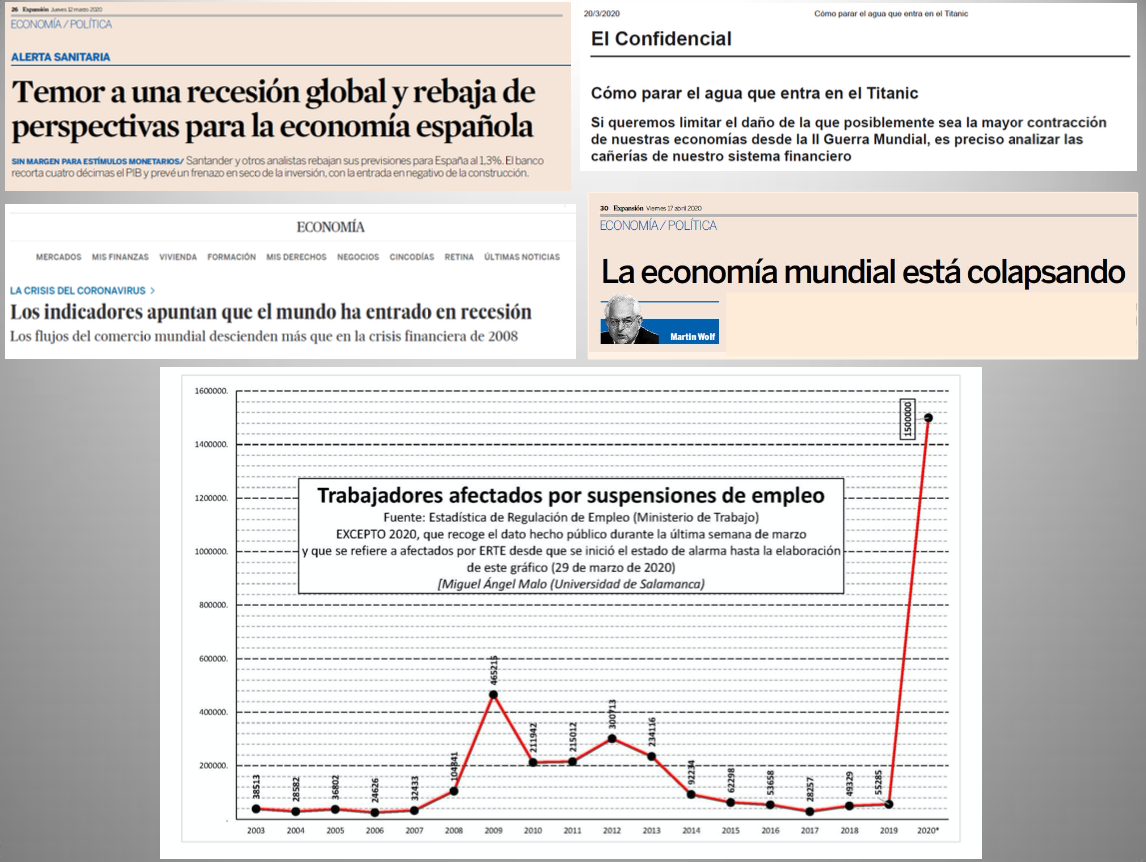
Diap 38. Debe decirse con absoluta claridad que los patrones de morbilidad y mortalidad que exhibe el SARS-CoV-2 no le facultan en modo alguno para afectar severamente a nuestro tejido productivo ni para desatar por sí mismo una crisis económica global. Eso podría hacerlo un nuevo virus de la viruela o una nueva peste neumónica, pero no así este virus. De hecho, el virus gripal A/H2N2 de la pandemia de 1957, con su rastro de 1,7 millones de muertos en un mundo con la mitad de habitantes que el actual, no lo hizo en ningún grado, y la comparación entre el SARS-CoV-2 y los virus de la gripe es muy pertinente por más que se pretenda a menudo descalificar, con argumentos muy débiles o casi inexistentes, a quienes la hacemos. La profundidad de la crisis económica que desaten en el mundo las medidas de contención frente al SARS- CoV-2, y su letalidad, dependerá de la severidad y la duración de esas medidas y de ninguna otra cosa. A finales de marzo, el número de trabajadores españoles afectados por los expedientes de regulación temporal de empleo triplicaba ya el registrado durante el pico máximo de la recesión que se inició en 2008 con la caída de Lehman Brothers, en la que el descenso del PIB per capita mundial tuvo su máximo en el 6,0%. Son consideraciones muy a tomar en cuenta en un momento en el que no pocos economistas serios, y no especialmente dados al catastrofismo, avisan que se está desatando ya la mayor recesión económica del período posterior a la Segunda Guerra Mundial. Si cristalizan esas predicciones, toda la responsabilidad será nuestra, y nadie podrá cargársela, legítimamente, al virus.
Conclusiones
De los hechos expuestos, este viejo virólogo jubilado concluye que asistimos a la explosiva expansión inicial de un nuevo virus respiratorio humano que, al margen de esa circunstancia coyuntural, no es especial en ningún otro sentido, por más que la pésima calidad de las cifras que manejamos hasta ahora para describir la epidemia pueda inducirnos a error. De hecho, llama poderosamente la atención que el veterano doctor Anthony Fauci, director del Instituto Nacional de Alergias y Enfermedades Infecciosas de los EEUU, declarase el pasado miércoles 15 de abril que creía que “el número de muertes en Estados Unidos por el coronavirus terminará siendo inferior a la proyección original”. Por su parte, el doctor Robert Redfield, director de los Centros para el Control de las Enfermedades de Atlanta, corroboró ese mismo día la declaración del doctor Fauci al manifestar que “esperaba que el número de muertes fuera mucho más bajo de lo que predijeron los modelos”. Incluso los expertos más cualificados pueden llegar a caer en la trampa de los malos números cuando la presión es alta…
Opino también que el papel que ha jugado la OMS en estos primeros -y en algún aspecto decisivos- momentos no ha sido nada positivo. Así, el señor Tedros Adhanom Ghebreyesus, su Director General, aún insistía el pasado lunes 13 de abril (dos días antes de las declaraciones de Fauci y Redfield en el sentido opuesto) en atemorizar al mundo al recordar que “la tasa de mortalidad del coronavirus es diez veces superior a la de la gripe”, sin mencionar, sin embargo, que su incidencia real es con muchísima probabilidad bastante más de diez veces superior a la de una temporada normal de gripe. Algunos sabemos distinguir entre mortalidad y letalidad, pero el ciudadano corriente conceptualiza letalidad cuando el Director General de la OMS le habla de mortalidad sin molestarse en explicarle nada más. Me pregunto cómo ha podido suceder eso, y reconozco que esta vez comprendo muy bien la reacción de un Presidente de los EEUU a quien suelo comprender mal y con cuyas opiniones rara vez coincido.
Para terminar, y combinando mis conocimientos de virólogo con los comentarios de algunos economistas del mayor prestigio, concluyo también que la reacción de nuestros gobiernos ha constituido un gran error cuyas severas consecuencias lamentaremos durante mucho tiempo, me temo que ya sin remedio. No les culpo del todo por ello, porque el organismo internacional que debía orientarles les orientó hacia el abismo desde el primer momento al no querer contemplar todos los aspectos del problema. En todo caso, vaya desde aquí todo mi apoyo para mi amigo y compañero el doctor Fernando Simón, un gran profesional a quien esta vez le tocó bailar un difícil y enrevesado tango. Deseo sinceramente que sigamos contando con él, por muchos años, al frente del Centro de Coordinación de Alertas y Emergencias Sanitarias del Ministerio de Sanidad.
Bibliografía
- Echevarría JM. El fatal destino de Roma. Virología 2019; 22:16-22.
- Pascual M. La ciudad ante el contagio: medidas políticas y administrativas dictadas en la epidemia de fiebre amarilla de 1804 en Alicante. Asclepio 2002; 54:125-153.
- Martínez VP et al. Person-to-person transmission of Andes virus. Emerg Infect Dis 2005; 11:1848-1853.
- Cheng VC et al. Severe Acute Respiraory Syndrome coronavirus as an agent of emerging and reemerging infection. Clin Microbiol Rev 2007; 20:660-694.
- Gaydos JC et al. Swine influenza A outbreak, Fort Dix, New Jersey, 1976. Emerg Infect Dis 2006; 12:23-28.
- Viboud C et al. Global mortality impact of the 1957-1959 influenza pandemic. J Infect Dis 2016: 738-745.
- Fukuda K. Declaración en nombre de la OMS durante la audiencia del Consejo de Europa sobre la pandemia de gripe por H1N1, 2009. Consejo de Europa, transcripción oficial en español. 26 de enero de 2010.
- Larrauri A et al. Epidemiology of 2009 influenza pandemic in Spain. The Spanish Influenza Surveillance System. Enferm Ifecc Microbiol Clín 2012; 30 (Supl4):2-9.
- Echevarría JM. The first influenza pseudopandemic of the 21st century? Enferm Infecc Microbiol Clín 2013; 31:269-270.
- Banerjee A et al. Bats and coronaviruses. Viruses 2019; 1, 41; DOI: https//doi.org/doi:10.3390/v11010041.
- Verity R et al. Estimates the severity of COVID-19 disease. Lancet Infect Dis 2020, March 30, DOI: https://doi.org/10.1016/S1473-3099(20)30243-7.
- Centro Nacional de Epidemiología. Informe de vigilancia de la gripe en España. Temporada 2018-2019. Instituto de Salud Carlos III, 2019.
- Imperial College COVID-19 Response Team. Impact of non-pharmaceutical interventions (NPIs) to reduce COVID-19 mortality and healthcare demand. Imperal College, London, 16 March 2020.
- Bendavid E et al. COVID-19 antibody serprevalence in Santa Clara County, California (enviado a publicación). https://doi.org/10.1101/2020.04.14.20062463.
- https://it.businessinsider.com/esclusiva-cosa-rivelano-i-primi-test-di-robbio-primo- paese-italiano-a-fare-i-test-sullimmunita-a-tutti-i-cittadini/
- Streeck H et al. Vorläufiges Ergebnis und Schlussfolgerungen der COVID-19 Case- Cluster-Study (Gemeinde Gangelt). https://www.technologyreview.com/2020/04/09/999015/blood-tests-show-15-of-people- are-now-immune-to-covid-19-in-one-town-in-germany/
- Thomas P. J-value assessment of how best to combat Covid-19. Nanotechnol Percept 2020, en prensa. http://www.jvalue.co.uk/papers/J-value-assessment-of- combating-Covid-19.pdf


